на какой день развивается цитокиновый шторм при ковиде
Самоубийство организма: врач из красной зоны объяснил, как предсказать цитокиновый шторм
Цитокиновый шторм — одна из главных причин гибели пациентов с COVID-19. Взбесивший иммунитет перестает различать родные и чужие белки, штурмуя все подряд. Но можно ли поймать «первую волну» и предотвратить дальнейшую катастрофу?
Что такое цитокиновый шторм
Анализ крови может показать повышенные уровни таких маркеров, как интерлейкин-6, интерлейкин-1, С-реактивный белок и фактор некроза опухоли-альфа. Чем раньше врачи поймают цитокиновый шторм и начнут его лечить, тем больше шансов, что пациент выживет.
Участковый терапевт: «Мне это не нужно»
Елена и ее муж заболели ковидом в середине мая. Оба лежали в Покровской городской больнице. Муж Елены — здоровый спортивный 47-летний мужчина — на кислородном концентраторе с сатурацией 77 (при норме 98). 42-летняя Елена считалась более тяжелой пациенткой, так как находилась в состоянии цитокинового шторма. Оба, к счастью, остались живы. Из больницы домой — к единственному 12-летнему сыну — они приехали только в середине июня.
Сейчас, спустя почти месяц после выписки, Елена анализирует события, предшествующие госпитализации, пытаясь понять, можно ли было как-то предупредить тяжесть заболевания. Ведь, как оказалось, анализ крови, которые она сдала в начале болезни, уже сигнализировал о сильном воспалительном процессе.
«Вот мне интересно, если бы в поликлиниках сразу же брали анализ крови на С-реактивный белок, можно ли было бы обойтись без подавления иммунитета и дорогостоящего препарата, который в дальнейшем используют в больницах?», — также задается вопросом Нэлли Вавилина, глава муниципального округа «Гавань», к которой Елена обратилась с проблемой.
Еще когда я лечилась дома, ко мне приезжал врач по ДМС и назначил анализ на С-реактивный белок. Когда пришли результаты, я увидела, что показатели завышены, причем сильно — при норме 5 было 83. Я показала их участковому терапевту, но она их просто отложила в сторону со словами: «Мне это не нужно».
Цитокиновый шторм при различных вариантах течения COVID-19
В декабре 2019 года в городе Ухань, Китай, был обнаружен новый штамм коронавируса, вызывающий тяжелый острый респираторный синдром — коронавирус 2 (SARS-CoV-2). Наряду с SARS-CoV и коронавирусом, ассоциированным с ближневосточным респираторным синдромом — (MERS-CoV), SARS-CoV-2 является третьим коронавирусом, вызывающим тяжелые респираторные заболевания у людей, объединенных под названием «коронавирусная болезнь 2019 года» (COVID-19). Эта вспышка была признана Всемирной организацией здравоохранения (ВОЗ) в марте 2020 года пандемией и оказала значительное влияние на экономику и здравоохранение во всем в мире.
Хотя ситуация развивается стремительно, тяжелое течение заболевания, проявляющееся лихорадкой и пневмонией, приводящее к острому респираторному дистресс-синдрому (ОРДС), было описано в 20 % случаев COVID-19. Это напоминает течение ОРДС, вызванного синдромом выброса цитокинов (цитокиновый шторм), и вторичный гемофагоцитарный лимфогистиоцитоз, наблюдаемый у пациентов с SARS-CoV и MERS-CoV, а также у пациентов с лейкемией, получающих Т-клеточную терапию. Учитывая этот опыт, необходимо создание терапевтических средств, основанных на подавлении синдрома выброса цитокинов, таких как тоцилизумаб, которые прошли клинические испытания для лечения COVID-19.
SARS-CoV-2 — это бета-коронавирус, который наиболее тесно связан с SARS-CoV. Оба вируса используют рецептор ангиотензинпревращающего фермента, связанный с карбоксипептидазой (ACE2), чтобы проникнуть в клетки. Этот рецептор повсеместно экспрессируется в сердечной и легочной ткани, а также в некоторых кроветворных клетках, включая моноциты и макрофаги. Ключевой особенностью инфекции COVID-19 является лимфопения (низкий уровень лимфоцитов в крови), которая коррелирует с клинической тяжестью процесса. При SARS-CoV инфицируются моноциты и дендритные клетки, тогда как при MERS-CoV инфицируются моноциты и Т-клетки через дипептидилпептидазу 4 (DPP4). Возможно, что SARS-CoV-2 также поражает дендритные клетки. Апоптоз и истощение пула Т-клеток в результате нарушения процессов активации из-за дисфункции дендритных клеток может способствовать патологии иммунной системы при COVID-19. Однако лимфопения не является специфическим биомаркером неблагоприятного прогноза при COVID-19, поскольку она также является биомаркером, который коррелирует с летальным исходом в пандемии гриппа A (H1N1) 2009 года.
Было установлено, что цитокиновый шторм является основным фактором тяжелого течения SARS-CoV и MERS-CoV у пациентов. Повышенные сывороточные концентрации интерлейкина-6 (IL-6) и других провоспалительных цитокинов являются признаками тяжелого течения инфекции MERS-CoV. Синдром высвобождения цитокинов часто встречается у пациентов с COVID-19, а повышенный уровень IL-6 в сыворотке коррелирует с дыхательной недостаточностью, ОРДС и неблагоприятными клиническими исходами. Повышенный уровень C-реактивного белка (CРБ),экспрессия которого стимулируется IL-6, также является биомаркером тяжелой бета-коронавирусной инфекции.
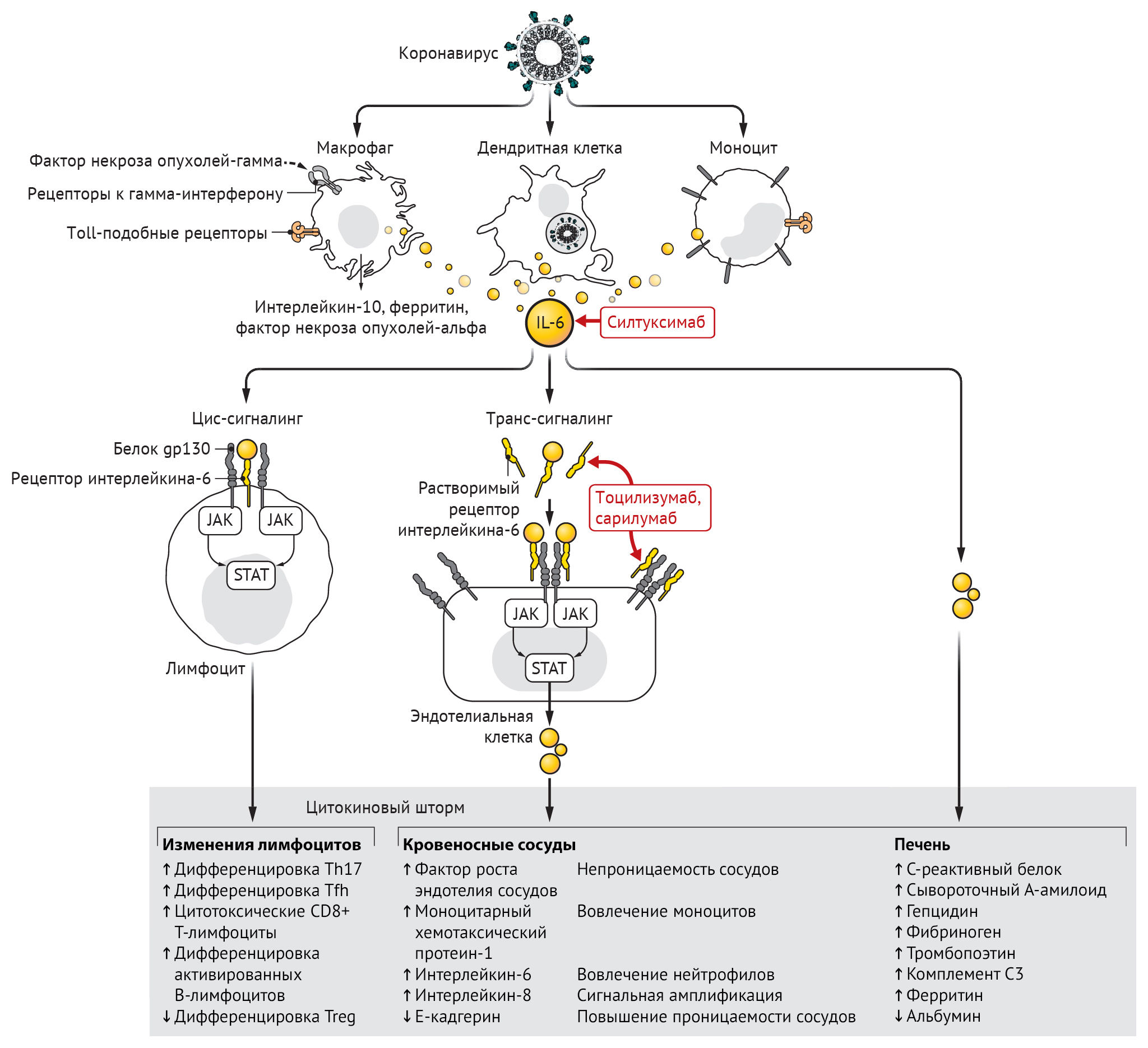
Инфицирование бета-коронавирусом моноцитов, макрофагов и дендритных клеток приводит к их активации и секреции IL-6 и других провоспалительных цитокинов. IL-6 обладает выраженными провоспалительными свойствами (см. рис. 1). IL-6 может передавать сигналы по двум основным путям, которые называются классической цис-передачей или транс-передачей. При передаче цис-сигналов IL-6 связывается с мембраносвязанным рецептором IL-6 (mIL-6R) в комплексе с gp130; нисходящая сигнальная трансдукция опосредуется, в свою очередь, JAKs (Janus kinases) и STAT3 (сигнальный преобразователь и активатор транскрипции-3). Связанный с мембраной комплекс gp130 экспрессируется повсеместно, в отличие от mIL-6R, экспрессия которого ограничена в основном иммунными клетками. Активация передачи сигналов в рамках цис-передачи приводит к плейотропным эффектам на приобретенный иммунитет (В- и Т-клетки), а также врожденную иммунную систему [нейтрофилы, макрофаги и естественные клетки-киллеры (NK)], которые могут вносить вклад в возникновение цитокинового шторма.
При передаче сигналов высокие концентрации циркулирующих IL-6 связываются с растворимой формой IL-6R (sIL-6R), образуя комплекс с димером gp130 на всех клеточных поверхностях. В результате сигнальный каскад IL-6-sIL-6R-JAK-STAT-3 активируется в клетках, которые не экспрессируют mIL-6R, таких как эндотелиальные клетки. Это приводит к системному «цитокиновому шторму», включающему секрецию сосудистого эндотелиального фактора роста (VEGF), хемоаттрактантного белка моноцитов–1 (МСР-1), IL-8 и дополнительного IL-6, а также снижение экспрессии E-кадгерина на эндотелиальные клетки. VEGF и пониженная экспрессия E-кадгерина способствуют проницаемости сосудов, которые участвуют в патофизиологии гипотонии и легочной дисфункции при ОРДС.
Вторичный гемофагоцитарный лимфогистиоцитоз — это гипервоспалительный синдром, характеризующийся высвобождением цитокинов, цитопенией (низкое количество клеток крови) и полиорганной недостаточностью (включая печеночную). У взрослых вторичный гемофагоцитарный лимфогистиоцитоз чаще всего связан с тяжелыми вирусными инфекциями, но также встречается у пациентов с лейкемией, получающих специальную Т-клеточную терапию. В дополнение к повышенным уровням цитокинов для вторичного гемофагоцитарного лимфогистиоцитоза характерны высокие уровни ферритина в сыворотке крови. Экспрессирующие CD163 макрофаги выступают в качестве источника ферритина. Учитывая их роль в передаче сигналов ретикулоэндотелиального железа, вторичный гемофагоцитарный лимфогистиоцитоз известен также как синдром активации макрофагов. Ретроспективное исследование пациентов с COVID-19 показало, что повышение сывороточного ферритина и IL-6 коррелировало с уровнем выживаемости и наблюдалось у погибших.
У пациентов, получающих CART-терапию (лечение Т-клетками химерного рецептора антигена (chimeric antigen receptor — CAR)), также могут развиться как цитокиновый шторм, так и вторичный гемофагоцитарный лимфогистиоцитоз. CART-терапия включает перепрограммирование Т-лимфоцитов пациента с целью повышения экспрессии на них молекул CAR, которые распознают антигены на опухолевых клетках. При переливании этих перепрограммированных клеток обратно пациенту они нацеливаются на опухолевые клетки, тем самым активируя противоопухолевый иммунный ответ. Эмили Уайтхед, первый пациент, получивший CD19-нацеленные Т-клетки CAR-19 с целью лечения острого лимфобластного лейкоза в 2012 году, побочным эффектом получила тяжелую форму цитокинового шторма и вторичного гемофагоцитарного лимфогистиоцитоза, что привело к развитию ОРДС, полиорганной недостаточности и гипотонии, которая была невосприимчива к стандартному лечению стероидами. Из-за значительного повышения сывороточного IL-6 у этой пациентки эмпирически было принято решение о начале терапии тоцилизумабом, антагонистом IL-6R, одобренным в то время для лечения ревматических состояний, таких как ювенильный идиопатический артрит. Она получала однократную дозу тоцилизумаба на 7-й день после введения CARТ-лимфоцитов. Спустя несколько часов у пациентки снизилась температура, после чего было принято решение об отмене лечения гипотонии и отказ от поддержки ИВЛ после разрешения ОРДС. В настоящее время тоцилизумаб с подтвержденной эффективностью и минимальными побочными эффектами у сотен пациентов одобрен Управлением по контролю за продуктами и лекарствами США (FDA) для лечения заболеваний, протекающих с синдромом цитокинового шторма, вызванного CARТ-терапией.
Эффективность антагонистов IL-6-IL-6R для лечения цитокинового шторма и вторичного гемофагоцитарного лимфогистиоцитоза подчеркивает центральную роль передачи сигналов IL-6 в патофизиологии цитокин-управляемых гипервоспалительных синдромов. Тяжелые случаи COVID-19 можно лечить как раз путем ингибирования пути IL-6, учитывая связанные с цитокиновым штормом и подобным вторичному гемофагоцитарному лимфогистиоцитозу повышения цитокинов в сыворотке крови. Действительно, предварительные результаты исследования 21 пациента с COVID-19, получавшего тоцилизумаб в Китае, обнадеживают: лихорадка спадала у всех пациентов в течение первого же дня приема тоцилизумаба. Потребность в кислороде была снижена у 75 % пациентов.
Во всем мире проводятся контролируемые клинические испытания с целью тестирования эффективности антагонистов IL-6 и IL-6R для лечения пациентов с COVID-19 с тяжелыми респираторными осложнениями. Один вопрос, который необходимо решить, заключается в том, будет ли иметь место дифференциальная эффективность между антагонистами IL-6 и антагонистами IL-6R. Относительно этого поднимается вопрос, что ингибиторы IL-6R могут подавлять как цис-, так и транс-передачу сигналов, а также транс-презентацию, недавно описанный третий способ передачи сигналов. Транс-презентация включает связывание IL-6 с mIL-6R, экспрессируемым на иммунной клетке, которая образует комплекс с gp130 на клетках T-хелпера-17 (TH17), что приводит к передаче сигналов Т-клеток вниз по каскаду, который может приводить к ОРДС. Однако ингибиторы IL-6 могут подавлять только цис- и транс-передачу сигналов. Непосредственная цель применения антагонистов IL-6 состоит в том, чтобы облегчить течение тяжелых случаев COVID-19 и свести к минимуму потребности в интенсивной терапии данных пациентов. Долгосрочная цель должна заключаться в разработке противовирусных препаратов и вакцин, которые предотвращают инфекцию или облегчают ее течение.
Есть ряд предостережений, которые необходимо брать во внимание, учитывая глобальную потребность в терапии COVID-19. При сепсис-ассоциированном ОРДС часто назначают кортикостероиды. Однако применение кортикостероидов у пациентов с SARS и MERS не улучшило показатели выживаемости и не привело к каким-либо изменениям вирусного клиренса. В результате консенсус экспертов-инфекционистов из профильных институтов и ВОЗ рекомендует клиницистам избегать системных кортикостероидов у пациентов с COVID-19 в настоящее время. Теоретическая возможность состоит в том, что подавление воспаления антагонистами IL-6 может задержать выведение вируса из организма. Однако блокада IL-6 также приводит к быстрому снижению сывороточного IL-10, иммуносупрессивного цитокина, секретируемого макрофагами, что может смягчить опасения по поводу продления клиренса вируса. Более того, одна или две дозы антагониста IL-6 вряд ли приведут к таким осложнениям, как грибковые инфекции или остеонекроз челюсти, возникающие у пациентов, которым ежемесячно вводят эти препараты для лечения хронических состояний, например, ревматоидного артрита. Примечательно, что тоцилизумаб был впервые одобрен для лечения ревматических заболеваний, а затем — цитокинового шторма у пациентов, получающих CARТ-терапию, и в настоящее время подвергается «перепрофилированию» для борьбы с пандемией COVID-19. Вполне возможно, что направленная на IL-6 терапия будет использоваться в лечении пациентов на случай будущих пандемий, вызванных другими вирусами, таких как грипп и лихорадка Эбола.
Критический анализ концепции «цитокиновой бури» у пациентов с новой коронавирусной инфекцией COVID-19. Обзор литературы
1 ГБУЗ «Городская клиническая больница №40» ДЗМ, Москва, Россия
2 ФГАОУ ВО «Национальный исследовательский медицинский университет им. Н.И. Пирогова» МЗ РФ, Москва, РФ
Для корреспонденции: Самойленко Валерий Вячеславович — канд. мед. наук, заведующий терапевтическим отделением ГБУЗ ГКБ № 40 ДЗМ, Москва, Россия; e-mail: vvsamdoctor@gmail.com
Для цитирования: С.С. Бобкова, А.А. Жуков, Д.Н. Проценко, В.В. Самойленко, И.Н. Тюрин. Критический анализ концепции «цитокиновой бури» у пациентов с новой коронавирусной инфекцией COVID-19. Обзор литературы. Вестник интенсивной терапии им. А.И. Салтанова. 2021;1:57–68. DOI: 10.21320/1818-474X-2021-1-57-68
Реферат
Актуальность. Новая коронавирусная инфекция, вызванная вирусом SARS-CoV-2, характеризуется системной гипервоспалительной реакцией с выраженным повышением содержания провоспалительных цитокинов, получившей название «цитокиновая буря». По современным представлениям, «цитокиновая буря» является ведущей причиной развития тяжелой клинической картины COVID-19 и прогрессирования заболевания до полиорганной недостаточности.
Цель исследования. Проведение критического анализа концепции «цитокиновой бури» у пациентов с COVID-19 на основании данных литературы.
Результаты. При сравнении цитокинового ответа при COVID-19 и других синдромах, характеризующихся феноменом «цитокиновой бури», в частности гемофагоцитарного лимфогистиоцитоза и синдрома высвобождения цитокинов, выявляются существенные различия, и поэтому патогенез возникновения нарушений цитокинового ответа при COVID-19 нуждается в дальнейшем уточнении. К настоящему времени накоплены клинические данные, свидетельствующие о потенциальной пользе применения противовоспалительной иммуномодулирующей терапии у пациентов с тяжелым течением COVID-19. Несмотря на проведенные многочисленные исследования по оценке эффективности и безопасности таргетной терапии иммуномодулирующими препаратами, однозначных выводов и рекомендаций по их применению нет. Кроме того, результаты ряда работ ставят под сомнение ведущую роль «цитокиновой бури» в патогенезе прогрессирования COVID-19.
Заключение. Имеющиеся данные позволяют предположить, что нарушение регуляции цитокинового ответа является одним из механизмов, лежащих в основе прогрессирования COVID-19 и развития органной недостаточности. В то же время выраженность данных нарушений у части больных не позволяет объяснить развитие тяжелых осложнений, в связи с чем необходим поиск альтернативных патогенетических механизмов.
Ключевые слова: COVID-19, SARS-CoV-2, цитокины, «цитокиновая буря», гипервоспалительный синдром, иммуномодулирующая терапия
Поступила: 08.02.2021
Принята к печати: 05.03.2021
Функции цитокинов
Цитокины представляют собой уникальную группу эндогенных полипептидных медиаторов межклеточного взаимодействия, включающую в настоящее время около 300 молекул, объединенных в несколько семейств. История изучения цитокинов насчитывает несколько десятилетий, но сам термин «цитокины» был предложен в 1974 г. Стэнли Коэном, предположившим, что гуморальные факторы, секретируемые из клетки, не являются исключительной особенностью лимфоцитов и моноцитов, как считалось ранее, когда данные вещества подразделялись на лимфокины и монокины [1]. В 1990 гг. было открыто субъединичное строение цитокиновых рецепторов и сформировано понятие «цитокиновая сеть». Таким образом, система цитокинов представляет собой универсальную регуляторную сеть медиаторов, предназначенных для контроля процессов пролиферации, дифференцировки и функциональной активности клеточных элементов в кроветворной, иммунной и в других системах организма [2, 3].
По механизму действия цитокины можно условно подразделить на следующие группы:
Цитокины ответственны за развитие местных защитных реакций в тканях с участием различных типов клеток крови, эндотелия, эпителия и соединительной ткани. На местном уровне цитокины регулируют все последовательные этапы развития воспаления и адекватность ответа на внедрение патогена. Адекватность воспалительного ответа степени повреждения является основным условием сохранения защитной функции воспалительной реакции [6–8].
«Цитокиновая буря»
Гиперпродукция цитокинов приводит к развитию системной воспалительной реакции, нарушению функции отдаленных органов, при этом дальнейшее нарастание концентрации может служить причиной развития ряда критических состояний, в частности, септического шока и полиорганной недостаточности [9–11].
В последние годы для образного описания потенциально фатальной, неконтролируемой генерализованной воспалительной реакции, вызванной нарушением регуляции цитокинов с их массивным высвобождением и избыточным поступлением в периферическую кровь, стал широко применяться термин «цитокиновая буря» [12–14], впервые использованный в 1993 г. Джеймсом Феррарой у пациентов с реакцией «трансплантат против хозяина» [15]. До начала пандемии, вызванной новой коронавирусной инфекцией, феномен «цитокиновой бури» был описан при целом ряде вирусных инфекций [16, 17], включая цитомегаловирусный пневмонит [18], лихорадку денге [19], хантавирусную инфекцию [20], грипп [21–23], тяжелый острый респираторный синдром (Severe acute respiratory syndrome, SARS) [24–26] и ближневосточный респираторный синдром (Middle East respiratory syndrome, MERS) [26].
Для объяснения патофизиологических механизмов возникновения феномена «цитокиновой бури» было предложено несколько теорий [27, 28].
Теория «суперантигена». В обычных условиях активация Т-клеток происходит только тогда, когда специфический антиген, связанный с молекулами главного комплекса гистосовместимости II класса, взаимодействует с рецепторами Т-клеток (ТКР), что приводит к активации специфического клона Т-клеток, который начинает пролиферировать. Однако некоторые бактерии обладают способностью образовывать суперантиген (стафилококковый токсин), который связывается с Vβ-областью ТКР. Это связывание не характеризуется какой-либо специфичностью, в результате чего происходит активация значительного количества T-клеток (до 20 % общего количества Т-клеток организма), что, в свою очередь, приводит к массивному высвобождению цитокинов и развитию феномена «цитокиновой бури» [29]. Классическим примером данного механизма является синдром инфекционно-токсического шока при стафилококковой или стрептококковой инфекции [30].
Нарушение цитолитического пути. CD8 T-клетки (цитотоксические T-клетки) и естественные киллеры (NK-клетки) играют важную роль в защите от внутриклеточных инфекций, в частности вирусных. Данный процесс представляет собой уничтожение инфицированных клеток за счет высвобождения перфорина и гранзимов — цитотоксических белков, содержащихся в гранулах Т-лимфоцитов и NK-лимфоцитов естественных киллеров (цитолитический путь). Нарушение цитолитического пути приводит к избыточному образованию цитокинов (ведущую роль играет ИФН-γ), и наиболее характерным примером развития феномена «цитокиновой бури» по данному механизму является гемофагоцитарный лимфогистиоцитоз [31].
Дефекты врожденного иммунитета. Toll-подобные рецепторы (TLR), опосредующие распознавание молекулярных структур патогенов, экспрессируются на клетках разных типов, инициируя развитие иммунных реакций при связывании с различными лигандами. Дефекты путей передачи, связанных с TLR, могут приводить к аберрантной активации иммунной системы и развитию феномена «цитокиновой бури» [32].
Иммунодефицитные состояния. Пациенты с первичным иммунодефицитом обладают ограниченными возможностями для полной элиминации патогена из организма. Персистирующая инфекция запускает механизм высвобождения цитокинов, что приводит к развитию гемофагоцитарного лимфогистиоцитоза. Например, данный синдром развивается на фоне инфекции вирусом Эпштейна—Барр у пациентов с лимфопролиферативным синдромом, сцепленным с Х-хромосомой [33, 34].
Патогенетические варианты синдрома «цитокиновой бури»
Феномен «цитокиновой бури» является в большей степени описательным термином, который охватывает различный спектр клинических проявлений и изменений лабораторных показателей и не имеет четко определенных диагностических критериев. В то же время в рамках данного феномена можно выделить несколько его патогенетических вариантов, представленных вполне сложившимися клинико-лабораторными синдромами.
Синдром высвобождения цитокинов, СВЦ (Cytokine release syndrome, CRS). Термин был впервые использован в 1980-х гг. для описания клинических проявлений «цитокиновой бури» после инфузии муромонаба-CD3 (OKT3) [35]. В последующем этот термин занял прочное место при описании осложнений, связанных с противоопухолевой терапией модифицированными Т-клетками с химерным антигенным рецептором к CD19 (Chimeric Antigen Receptor T-Cell, СAR-T) и моноклональными антителами [36, 37]. При развитии СВЦ наблюдается быстрое и массивное освобождение цитокинов в кровоток, источником которых являются как CAR Т-клетки, так и вторичные клетки-эффекторы. Клиническими проявлениями СВЦ выступают высокая лихорадка, общее недомогание, усталость, миалгия, тошнота, анорексия, тахикардия/гипотония, сердечная дисфункция, почечная и печеночная недостаточность и диссеминированная внутрисосудистая коагуляция. Тяжелое течение СВЦ может привести к полиорганной недостаточности и летальному исходу [38].
Что касается диагностических критериев СВЦ, то они включают в себя типичные клинические проявления (наиболее существенные — лихорадка, а также наличие не менее одного признака органной токсичности: гипотония, гипоксемия, неврологические проявления), лабораторные критерии «цитокиновой бури» (повышение активности С-реактивного белка, ИЛ-6, ферритина и т.д.) и недавнее лечение любым биологическим препаратом [39].
В настоящее время существует несколько классификаций СВЦ, например, классификация по степени тяжести в Общих терминологических критериях для обозначения нежелательных явлений (Common Terminology Criteria for Adverse Events, CTCAE v.5), Lee Grading Scale, MD Anderson Grading Scale, Penn Grading Scale, на основании которых выделяют 4 степени тяжести синдрома. Наиболее часто используется классификация CTCAE v5.0, в соответствии с которой 1-я степень тяжести включает в себя лихорадку; 2-я степень — артериальную гипотонию, для коррекции которой достаточно введение жидкости, и гипоксемию, отвечающую на респираторную поддержку с фракцией вдыхаемого кислорода (FiO2) 0,4; 4-я степень — жизнеугрожающее состояние. СВЦ имеет собственный код в МКБ-10 — D89.83. В 2017 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (Food and Drug Administration, FDA) одобрило применение препарата тоцилизумаб для лечения вызванного CAR T-клетками тяжелого или жизнеугрожающего синдрома высвобождения цитокинов у пациентов от двух лет и старше [40].
Гемофагоцитарный лимфогистиоцитоз, или гемофагоцитарный синдром, ГФС (Hemophagocytic lymphohistiocytosis, HLH), представляет собой тяжелую генерализованную воспалительную реакцию, в патогенезе которой ключевую роль играет активация макрофагов, цитотоксических лимфоцитов и естественных киллеров (NK-клеток), развитие лавинообразной гиперцитокинемии с тяжелыми вторичными тканевыми повреждениями. Впервые ГФС был описан J.W. Farquhar и А.Е. Claireaux в 1952 г. [41]. В соответствии с актуальной классификацией Международного гистиоцитарного общества первичный и вторичный ГФС относятся к H-группе гистиоцитозов. Первичный ГФС относится к аутосомно-рецессивным, генетически обусловленным заболеваниям, обычно развивается у детей первых лет жизни. Вторичный ГФС развивается на фоне инфекционного, опухолевого или аутоиммунного процесса. В 1979 г. Risdall et al. описали развитие ГФС на фоне вирусной инфекции [42]. К настоящему времени описано развитие вторичного ГФС у пациентов с инфекцией, вызванной вирусами Эпштейна—Барр, простого герпеса, гриппа, гепатита, иммунодефицита человека, а также цитомегаловирусной, парвовирусной, аденовирусной и коронавирусной инфекциями [43–45]. Клинически вторичный, или реактивный, ГФС проявляется, как правило, упорной лихорадкой, увеличением печени и селезенки, развитием полиорганной недостаточности, цитопении и вторичных инфекций. Для диагностики вторичного ГФС были разработаны критерии H-Score [46] (табл. 1).
Таблица 1. Диагностические критерии вторичного ГФС (H-Score) [46]
Table 1. H-score diagnostic criteria for secondary HLH [46]
Параметры
Баллы
Температура тела, °С:
гепато- ИЛИ спленомегалия
Количество угнетенных ростков кроветворения (гемоглобин 9 /л, и/или тромбоциты 9 /л):
Содержание ферритина в сыворотке крови, нг/мл:
Содержание триглицеридов в сыворотке крови, ммоль/л:
Содержание фибриногена в плазме, г/л:
Содержание аспартатаминотрансферазы сыворотки, МЕ/л:
2000 нг/мл и повышение содержания любого другого маркера воспаления или 2) повышение содержания ≥ 4 маркеров воспаления, включая C-реактивный белок > 70 мг/л; ферритин > 700 нг/мл, D-димер > 1000 нг/мл, триглицериды > 265 мг/дл, АСТ > 59 ЕД/л, ЛДГ > 300 ЕД/л, лимфопения 8000 клеток/мкл [67]. Диагностические критерии The COVID-19 Pandemic Health System REsilience PROGRAM (REPROGRAM) consortium включают в себя: повышение содержания одного из маркеров воспаления (ферритин > 1000 нг/мл, С-реактивный белок > 25 мг/л и повышение содержания ИЛ-6); наличие дыхательной недостаточности, двусторонней пневмонии и прогрессирующее увеличение потребности в неинвазивной респираторной поддержке; d-димер >1000 нг/мл, ЛДГ > 300 ЕД/л, лимфопения 0,5 нг/мл и АСТ > ЕД/л [68]. Наиболее сложную систему диагностических критериев синдрома «цитокиновой бури» при COVID-19 предложила исследовательская группа Temple University [69] (табл. 2).
Таблица 2. Диагностические критерии синдрома «цитокиновой бури» Temple University COVID-19 Research Group [69]
Table 2. Temple University COVID-19 Research Group diagnostic criteria for “cytokine storm” in COVID-19 [69]
Обязательные критерии:
1) клинические проявления инфекции;
2) лабораторное подтверждение инфекции;
3) характерные изменения на КТ;
4) ферритин > 250 нг/мл;
+ по 1 критерию из каждой группы дополнительных критериев:
группа I
группа II
группа III
альбумин 11,4 клеток/мкл
тропонин I > 1,09 нг/мл
анион. разн. 106 ммоль/л;
мочевина : креатинин > 29
АЛТ — аланинаминотрансфераза; анион. разн. — анионная разница; АСТ — аспартатаминотрансфераза, ЛДГ — лактатдегидрогеназа; мочевина : креатинин — соотношение мочевина/креатинин; СРБ — С-реактивный белок.
Кроме того, в рамках феномена «цитокиновой бури» при COVID-19 были сформулированы диагностические критерии еще двух самостоятельных клинико-лабораторных синдромов: мультисистемного воспалительного синдрома у взрослых (Multisystem Inflammatory Syndrome in Adults [MIS-A]) и гипервоспалительного синдрома [70] (табл. 3 и 4).
Таблица 3. Диагностические критерии мультисистемного воспалительного синдрома [71]
Table 3. Diagnostic criteria for Multisystem Inflammatory Syndrome in Adults (MIS-A) [71]
1. Тяжелые клинические проявления заболевания у пациентов ≥ 21 года, требующие стационарного лечения.
2. Подтвержденная коронавирусная инфекция, вызванная вирусом SARS-CoV-2.
3. Выраженное нарушение функции одной или более систем, кроме дыхательной (например, гипотензия или шок, артериальный или венозный тромбоз/эмболия, острое повреждение печени.
4. Лабораторные признаки выраженной воспалительной реакции (например, повышение содержания С-реактивного белка, ферритина, D-димера или ИЛ-6).
5. Отсутствие тяжелого поражения органов дыхания (для исключения ситуации, когда органная дисфункция и воспаление связано с тканевой гипоксией.
Критерии применимы к пациентам со слабо или умеренно выраженными респираторными симптомами; не применимы — к пациентам с альтернативным диагнозом, например бактериальным сепсисом.
Таблица 4. Диагностические критерии гипервоспалительного синдрома [72]
Table 4. Diagnostic criteria for hyperinflammatory syndrome in COVID-19 [72]
Лихорадка
· Температура тела > 38,0 °C
Активация макрофагов
· Повышение содержания ферритина ≥ 700 мкг/л
Гематологические нарушения
· Отношение нейтрофилы : лимфоциты ≥ 10 ИЛИ 2 признака: содержание гемоглобина ≤ 9,2 г/дл И тромбоцитов ≤ 110 × 10 9 /л
Коагулопатия
· Содержание D-димера ≥ 1,5 мкг/мл
Повреждение печени
· ЛДГ ≥ 400 ЕД/л ИЛИ АСТ ≥ 100 ЕД/л
Цитокинемия
· Содержание ИЛ-6 ≥ 15 пкг/мл, ИЛИ триглицеридов ≥ 150 мг/дл, ИЛИ С-реактивного белка ≥ 15 мг/дл
АЛТ — аланинаминотрансфераза; АСТ — аспартатаминотрансфераза, ЛДГ — лактатдегидрогеназа.
Широкое принятие концепции «цитокиновой бури» привело к кардинальной смене парадигмы лечения инфекционных заболеваний: впервые в комплексном лечении вирусной инфекции стали активно применяться лекарственные средства супрессивной иммунотерапии с механизмом прицельного лечебного воздействия, блокирующего эффекты цитокинов [73–75]. Попытки коррекции избыточного цитокинового ответа при вирусных инфекциях предпринимались и раннее, но при обосновании различных вмешательств применение моноклональных антицитокиновых антител не рассматривалось [76, 77]. Энтузиазм по поводу иммуномодулирующего подхода в лечении COVID-19, по-видимому, в значительной степени был связан с клиническим опытом лечения синдрома высвобождения цитокинов, который часто подменяют термином «цитокиновая буря». В связи с этим не вызывает удивления тот факт, что первым препаратом таргетной биологической терапии стал тоцилизумаб [78]. В то же время применение данного препарата для лечения гипериммунного воспалительного ответа у пациентов с COVID-19 неоднозначно с нескольких позиций.
Во-первых, весь предшествующий опыт применения тоцилизумаба охватывал только неинфекционные заболевания, поэтому чисто теоретически подавление воспаления с помощью блокады рецепторов ИЛ-6 может не только продлить период виремии, но и способствовать прогрессированию вирусного поражения [79, 80].
Во-вторых, взяв за аналогию синдром высвобождения цитокинов, где применение тоцилизумаба получило одобрение, нельзя упускать из виду другой патогенетический вариант «цитокиновой бури» — ГФС/САМ, при котором применение тоцилизумаба не является предпочтительным вследствие увеличения риска развития бактериальной инфекции [81], длительного периода полувыведения, а также снижения содержания С-реактивного белка и ферритина в отсутствие клинического ответа, что может ввести в заблуждение при оценке эффекта от лечения [82].
Кроме того, при применении тоцилизумаба возможно развитие парадоксальной реакции, проявляющейся реактивацией вторичного ГФС [82]. По мнению некоторых исследователей, цитокиновый ответ у пациентов с COVID-19 в большей степени напоминает таковой при сепсисе, чем при ГФС/CAM на фоне онкогематологических или иммуновоспалительных заболеваний, поэтому, хотя ИЛ-6 является составным компонентом цитокинового каскада, его роль в развитии органной дисфункции не ясна, а эффект от блокады его рецепторов может оказаться очень ограниченным [83].
Несмотря на то что тоцилизумаб вошел в национальные рекомендации по лечению COVID-19 в России, Китае, Италии, Испании, Греции, Швейцарии, Ирландии, Польши, Турции, Израиля, Японии, Египта, Ирана и еще ряда стран (по показаниям, отличающимся от утвержденных в инструкции показаний для применения — off label), до настоящего времени данные о его эффективности и безопасности при применении у пациентов с COVID-19 носят противоречивый характер. В то время как данные о положительном эффекте применения получены преимущественно на основании обсервационных исследований и описания серии наблюдений [84–88], результаты опубликованных рандомизированных контролируемых исследований менее впечатляющие [89–93] (табл. 5).
Таблица 5. Рандомизированные контролируемые исследования тоцилизумаба при COVID-19
Table 5. Randomized controlled studies with tocilizumab in COVID-19
RCT-TCZ-COVID-19 [94]
BACC Bay group [95]
COVACTA [96]
CORIMUNO-TOCI-1 [97]
TOCIBRAS [98]
EMPACTA [99]
REMAP-CAP [100]
Количество пациентов, получавших тоцилизумаб
Доля пациентов, получавших системные кортикостероиды, %
Различия в смертности
Анализ объединенных результатов данных исследований не выявил положительного влияния тоцилизумаба в отношении снижения смертности (ОШ 0,91, 95% ДИ 0,72–1,14) [101]. В результате систематического обзора исследований тоцилизумаба при COVID-19 Cortegiane et al. пришли к заключению, что в настоящее время не имеется убедительных данных в отношении пользы применения тоцилизумаба у пациентов с тяжелым течением COVID-19. Авторы отметили низкое качество многих исследований, связанное с большим количеством систематических ошибок [102]. Действительно, несмотря на достаточно большое количество исследований, посвященных изучению применения тоцилизумаба у пациентов с COVID-19, их результаты не позволяют сделать однозначный вывод. Отчасти это связано со значительными различиями в первичных конечных точках, критериях включения, сроках введения препарата, а также гетерогенностью выборки и небольшим количеством пациентов. Возможно, результаты исследования RECOVERY, предварительные результаты которого продемонстрировали положительный эффект тоцилизумаба, позволят завершить дискуссию в отношении данного вопроса [101]. Пока, на основании имеющихся данных, можно сделать несколько выводов: 1) применение тоцилизумаба в виде монотерапии не оказывает достоверного положительного эффекта пациентам с COVID-19; 2) тоцилизумаб в сочетании с системными кортикостероидами может оказывать положительный эффект у пациентов с тяжелым течением COVID-19; 3) терапия тоцилизумабом не приводит к значительному увеличению инфекционных осложнений.
Таким образом, в настоящее время в контексте феномена «цитокиновой бури» необходимо проведение дополнительных исследований, целью которых является получение убедительного ответа на вопрос: какое влияние оказывает на патогенез развития осложнений при COVID-19 повышение содержания цитокинов и насколько нейтрализация их биологических эффектов путем прицельного лечебного воздействия приносит пользу больным.
Критика концепции «цитокиновой бури» при COVID-19
В отношении концепции «цитокиновой бури», как ведущего патогенетического механизма прогрессирования COVID-19, существуют и противоположные мнения. О важной роли, которую играют цитокины в воспалительном ответе, сопровождающем вирусные инфекции, известно давно [94, 95]. При этом также не подвергается сомнению тот факт, что у части пациентов возникает избыточная воспалительная реакция, определяющая тяжесть течения заболевания [96, 97]. В то же время некоторые авторы полагают, что имеющихся в настоящее время данных недостаточно, чтобы однозначно определить значение нарушения цитокинового ответа у пациентов с COVID-19 [98]. В работе Mudd P.A. et al. было показано, что, хотя у пациентов с COVID-19 имеются различные нарушения иммунного ответа, классический фенотип «цитокиновой бури» наблюдается всего у 3–4 % пациентов, при этом выраженность цитокинемии значительно ниже, чем при других состояниях, сопровождающихся повышением содержания цитокинов. Исходя из полученных данных, авторы делают вывод, что использование термина «цитокиновая буря» для описания нарушений цитокинового ответа при COVID-19 не является корректным [99]. Nigrovic P.A. справедливо отмечает, что стандартизированные шкалы для диагностики состояний, сопровождающихся феноменом «цитокиновой бури» (например, H-Score) мало подходят для пациентов с COVID-19. Развернутая клиническая картина COVID-19, хотя и включает в себя повышение содержания воспалительных маркеров, но их концентрация практически никогда не достигает значений, наблюдающихся при синдроме высвобождения цитокинов или ГФС, при этом для пациентов с COVID-19 не характерны гепато- и спленомегалия, а лимфопения, возможно, возникает вследствие прямого действия вируса [100]. Более того, в ряде работ убедительно показано, что гипериммунный воспалительный ответ у пациентов с COVID-19 имеет существенные отличия от феномена «цитокиновой бури», наблюдающегося у пациентов с вторичным ГФС [101, 102]. По мнению группы китайских исследователей, избыточная продукция цитокинов может являться лишь «верхушкой айсберга» сложных патогенетических механизмов, лежащих в основе прогрессирования COVID-19, и не быть причиной клинического ухудшения состояния пациентов [103].
С другой стороны, содержание ИЛ-6 у пациентов с COVID-19 значительно ниже, по сравнению с пациентами с пневмонией, вызванной другими инфекционными агентами [104], ОРДС, сепсисом и особенно с синдромом высвобождения цитокинов как осложнением противоопухолевой терапии, в частности CAR-T [72, 105]. По мнению Leisman D.E. et al., спектр воспалительных маркеров у пациентов с COVID-19 значительно отличается от такового при ОРДС, сепсисе и классическом синдроме высвобождения цитокинов; роль повышения содержания цитокинов остается не ясной, поэтому от термина «цитокиновая буря» при описании воспалительного ответа у больных с COVID-19 предпочтительнее отказаться. Авторы полагают, что необходимо сместить акцент с концепции «цитокиновой бури» на поиск альтернативных патогенетических механизмов развития органной дисфункции, таких как эндоваскулит, прямое повреждающее действие вируса, лимфодеплеция и т. д. [72]. В пользу последней теории, или концепции «иммунологического коллапса», свидетельствуют результаты работы Remy K.E. et al., которые показали, что у пациентов с COVID-19 имеются выраженные нарушения механизмов иммунной защиты, проявляющиеся как в уменьшении количества эффекторных иммунных клеток, так и в нарушениях функции Т-клеток и моноцитов [106]. В связи с чем ряд авторов предлагают акцентировать внимание не только на коррекции избыточного цитокинового ответа, но и на восстановление функции Т-клеток [107, 108].
Заключение
Таким образом, имеющиеся данные позволяют предположить, что нарушение регуляции цитокинового ответа является одним из возможных патогенетических механизмов, лежащих в основе прогрессирования COVID-19 и развития органной недостаточности. Что касается терминологии, в частности оправданности использования термина «цитокиновая буря», то в данном случае, на наш взгляд, следует прислушаться к Рене Декарту, советовавшему не спорить, а договариваться о значениях слов [109]. Продвигаясь в данном направлении, необходимо установить единые пороговые критерии для лабораторных показателей, выбранных в качестве биологических маркеров синдрома «цитокиновой бури», и определить однозначные диагностические критерии. С другой стороны, хотелось бы обратить внимание на необходимость более широкого взгляда на патогенез COVID-19, не ограничивающегося только концепцией «цитокиновой бури».
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов. Бобкова С.С., Жуков А.А., Проценко Д.Н., Самойленко В.В., Тюрин И.Н. — разработка концепции статьи, получение и анализ фактических данных, написание и редактирование текста статьи, проверка и утверждение текста статьи.
ORCID авторов
Литература
Cohen S., Bigazzi P.E., Yoshida T. Commentary: Similarities of T cell function in cell-mediated immunity and antibody production. Cell Immunol. 1974; 12: 150–159. DOI: 10.1016/0008-8749(74)90066-5
Curfs J., Meis J., Hoogkamp-Korstanje A. A Primer on Cytokines: Sources, Receptors, Effects, and Inducers.Clinical Microbiology Reviews. 1997: 742–780. DOI: 10.1128/CMR.10.4.742-780.1997
Dinarello C.A. Historical insights into cytokines. Eur J Immunol. 2007; 37(Suppl. 1): S34–S45. DOI: 10.1002/eji.200737772
Gulati K., Guhathakurta S., Joshi J., et al. Cytokines and their Role in Health and Disease: A Brief Overview. MOJ Immunol. 2016; 4(2): 00121. DOI: 10.15406/moji.2016.04.00121
Oppenheim J.J. Cytokines: past, present, and future. Int J Hematol. 2001; 74(1): 3–8. DOI: 10.1007/BF02982543. PMID: 11530802
Billingham M.E. Cytokines as inflammatory mediators. Br Med Bull. 1987; 43(2): 350–370. PMID: 3319033. DOI: 10.1093/oxfordjournals.bmb.a072187
Alan A., Larry B. Cytokines and Inflammation. ImmunoMethods, 1993; 3(1): 3–12. DOI: 10.1006/immu.1993.1034
Kany S., Vollrath J.T., Relja B. Cytokines in Inflammatory Disease. Int J Mol Sci. 2019; 20(23): DOI: 10.3390/ijms20236008
Thijs L.G., Hack C.E. Time course of cytokine levels in sepsis. Intensive Care Med. 1995; 21(Suppl 2): S258–S263. DOI: 10.1007/BF01740764
Chousterman B.G., Swirski F.K., Weber G.F. Cytokine storm and sepsis disease pathogenesis. Semin Immunopathol. 2017; 39(5): 517–528. DOI: 10.1007/s00281-017-0639-8
Wang H., Ma S. The cytokine storm and factors determining the sequence and severity of organ dysfunction in multiple organ dysfunction syndrome. Am J Emerg Med. 2008; 26(6): 711–715. DOI: 10.1016/j.ajem.2007.10.031
Ferrara J.L., Abhyankar S., Gilliland D.G. Cytokine storm of graft-versus-host disease: a critical effector role for interleukin-1. Transplant Proc. 1993; 25(1 Pt 2): 1216–1217.
Tisoncik J.R., Korth M.J., Simmons C.P., et al. Into the eye of the cytokine storm. Microbiol Mol Biol Rev. 2012; 76(1): 16–32. DOI: 10.1128/MMBR.05015-11
Fajgenbaum D.C., June C.H. Cytokine Storm. N Engl J Med. 2020; 383(23): 255–2273. DOI: 10.1056/NEJMra2026131
Ferrara J.L. Cytokine dysregulation as a mechanism of graft versus host disease. Curr Opin Immunol. 1993; 5(5): 794–799. DOI: 10.1016/0952-7915(93)90139-j
Hussell T., Goulding J. Structured regulation of inflammation during respiratory viral infection. Lancet Infect Dis. 2010; 10(5): 360–366. DOI: 10.1016/S1473-3099(10)70067-0
Teijaro J.R. Cytokine storms in infectious diseases. Semin Immunopathol. 2017; 39(5): 501–503. DOI: 10.1007/s00281-017-0640-2
Barry S.M., Johnson M.A., Janossy G. Cytopathology or immunopathology? The puzzle of cytomegalovirus pneumonitis revisited. Bone Marrow Transplant. 2000; 26(6): 591–597. DOI: 10.1038/sj.bmt.1702562
Srikiatkhachorn A., Mathew A., Rothman A.L. Immune-mediated cytokine storm and its role in severe dengue. Semin Immunopathol. 2017; 39(5): 563–574. DOI: 10.1007/s00281-017-0625-1
Borges A.A., Campos G.M., Moreli M.L., et al. Hantavirus cardiopulmonary syndrome: immune response and pathogenesis. Microbes Infect. 2006; 8(8): 2324–2330. DOI: 10.1016/j.micinf.2006.04.019
La Gruta N.L., Kedzierska K., Stambas J., Doherty P.C. A question of self-preservation: immunopathology in influenza virus infection. Immunol Cell Biol. 2007; 85(2): 85–92. DOI: 10.1038/sj.icb.7100026
Liu Q., Zhou Y.-H., Yang Z.-Q. The cytokine storm of severe influenza and development of immunomodulatory therapy. Cell Mol Immunol. 2016; 13:3–10. DOI: 10.1038/cmi.2015.74
Guo X.J., Thomas P.G. New fronts emerge in the influenza cytokine storm. Semin Immunopathol. 2017; 39(5): 541–550. DOI: 10.1007/s00281-017-0636-y
Huang K.J., Su I.J., Theron M., et al. An interferon-gamma-related cytokine storm in SARS patients. J Med Virol. 2005; 75(2): 185–194. DOI: 10.1002/jmv.20255
Thiel V., Weber F. Interferon and cytokine responses to SARS-coronavirus infection. Cytokine Growth Factor Rev. 2008; 19(2):121–132. DOI: 10.1016/j.cytogfr.2008.01.001
Channappanavar R., Perlman S. Pathogenic human coronavirus infections: causes and consequences of cytokine storm and immunopathology. Semin Immunopathol. 2017; 39(5): 529–539. DOI: 10.1007/s00281-017-0629-x
Bhattad S. Cytokine Storm Syndrome: What Every Physician Must Know Today? Pediatr Inf Dis. 2020; 2(2): 79–81. DOI: 10.5005/jp-journals-10081-1251
Canna S.W., Cron R.Q. Highways to hell: Mechanism-based management of cytokine storm syndromes. J Allergy Clin Immunol. 2020; 146(5): 949–959. DOI: 10.1016/j.jaci.2020.09.016
Llewelyn M., Cohen J. Superantigens: microbial agents that corrupt immunity. Lancet Infect Dis. 2002; 2(3): 156–162. DOI: 10.1016/s1473-3099(02)00222-0
Papageorgiou A.C., Acharya K.R. Microbial superantigens: from structure to function. Trends Microbiol. 2000; 8(8): 369–375. DOI: 10.1016/s0966-842x(00)01793-5
Jessen B., Kögl T., Sepulveda F.E., et al. Graded defects in cytotoxicity determine severity of hemophagocytic lymphohistiocytosis in humans and mice. Front Immunol. 2013; 4: 448. DOI: 10.3389/fimmu.2013.00448
Olejnik J., Hume A.J., Mühlberger E. Toll-like receptor 4 in acute viral infection: Too much of a good thing. PLoS Pathog. 2018; 14(12): e1007390. DOI: 10.1371/journal.ppat.1007390
Bode S., Ammann S., Al-Herz W., et al. The syndrome of hemophagocytic lymphohistiocytosis in primary immunodeficiencies: implications for differential diagnosis and pathogenesis. Haematologica. 2015; 100(7): 978–988. DOI: 10.3324/haematol.2014.121608
Booth C., Gilmour K.C., Veys P., et al. X-linked lymphoproliferative disease due to SAP/SH2D1A deficiency: a multicenter study on the manifestations, management and outcome of the disease. Blood. 2011; 117: 53–62.
Chatenoud L., Bach J.F. Activation lymphocytaire T induite par les anticorps monoclonaux anti-CD3: physiopathologie du relargage de cytokines. C R Seances Soc Biol Fil. 1991; 185(5): 268–277.
Lee D.W., Gardner R., Porter D.L., et al. Current concepts in the diagnosis and management of cytokine release syndrome. Blood. 2014; 124(2): 188–195. DOI: 10.1182/blood-2014-05-552729
Shimabukuro-Vornhagen A., Gödel P., Subklewe M., et al. Cytokine release syndrome. J Immunother Cancer. 2018; 6(1): 56. DOI: 10.1186/s40425-018-0343-9
Xu X.J., Tang Y.M. Cytokine release syndrome in cancer immunotherapy with chimeric antigen receptor engineered T cells. Cancer Lett. 2014; 343(2):172–178. DOI: 10.1016/j.canlet.2013.10.004
García Roche A., Díaz Lagares C., Élez E., Ferrer Roca R. Cytokine release syndrome. Reviewing a new entity in the intensive care unit. Med Intensiva. 2019; 43(8): 480–488. DOI: 10.1016/j.medin.2019.01.009
Le R.Q., Li L., Yuan W., et al. FDA Approval Summary: Tocilizumab for Treatment of Chimeric Antigen Receptor T Cell-Induced Severe or Life-Threatening Cytokine Release Syndrome. Oncologist. 2018; 23(8): 943–947. DOI: 10.1634/theoncologist.2018-0028
Farquhar J.W., Claireaux A.E. Familial haemophagocytic reticulosis. Arch Dis Child. 1952; 27(136): 519–525. DOI: 10.1136/adc.27.136.519
Risdall R.J., McKenna R.W., Nesbit M.E., et al. Virus-associated hemophagocytic syndrome: a benign histiocytic proliferation distinct from malignant histiocytosis. Cancer. 1979; 44(3): 993–1002. DOI: 10.1002/1097-0142(197909)44:3 3.0.co;2-5
Tiab M., Mechinaud F., Harousseau J.L. Haemophagocytic syndrome associated with infections. Baillieres Best Pract Res Clin Haematol. 2000; 13(2): 163–178. DOI: 10.1053/beha.2000.0066
Rouphael N.G., Talati N.J., Vaughan C., et al. Infections associated with haemophagocytic syndrome. Lancet Infect Dis. 2007; 7(12): 814–822. DOI: 10.1016/S1473-3099(07)70290-6
Chen J., Wang X., He P., et al. Viral etiology, clinical and laboratory features of adult hemophagocytic lymphohistiocytosis. J Med Virol. 2016; 88(3): 541–549. DOI: 10.1002/jmv.24359
Fardet L., Galicier L., Lambotte O., et al. Development and validation of the HScore, a score for the diagnosis of reactive hemophagocytic syndrome. Arthritis Rheumatol. 2014; 66(9): 2613–2620. DOI: 10.1002/art.38690
Jordan M.B., Allen C.E., Greenberg J., et al. Challenges in the diagnosis of hemophagocytic lymphohistiocytosis: Recommendations from the North American Consortium for Histiocytosis (NACHO). Pediatr Blood Cancer. 2019; 66(11): e27929. DOI: 10.1002/pbc.27929
Ramos-Casals M., Brito-Zerón P., López-Guillermo A., et al. Adult haemophagocytic syndrome. Lancet. 2014; 383(9927): 1503–1516. DOI: 10.1016/S0140-6736(13)61048-X
Canna S.W., Behrens E.M. Making sense of the cytokine storm: a conceptual framework for understanding, diagnosing, and treating hemophagocytic syndromes. Pediatr Clin North Am. 2012; 59(2): 329–344. DOI: 10.1016/j.pcl.2012.03.002
La Rosée P., Horne A., Hines M., et al. Recommendations for the management of hemophagocytic lymphohistiocytosis in adults. Blood. 2019; 133(23): 2465–2477. DOI: 10.1182/blood.2018894618
Hadchouel M., Prieur A.M., Griscelli C. Acute hemorrhagic, hepatic, and neurologic manifestations in juvenile rheumatoid arthritis: possible relationship to drugs or infection. J Pediatr. 1985; 106(4): 561–566. DOI: 10.1016/s0022-3476(85)80072-x
Crayne C.B., Albeituni S., Nichols K.E., Cron R.Q. The Immunology of Macrophage Activation Syndrome. Front Immunol. 2019; 10: DOI: 10.3389/fimmu.2019.00119
Bracaglia C., Prencipe G., De Benedetti F. Macrophage Activation Syndrome: different mechanisms leading to a one clinical syndrome. Pediatr Rheumatol Online J. 2017; 15(1): Published 2017 Jan 17. DOI: 10.1186/s12969-016-0130-4
Stuart J. Carter, Rachel S. Tattersall, Athimalaipet V. Ramanan. Macrophage activation syndrome in adults: recent advances in pathophysiology, diagnosis and treatment, Rheumatology. 2019; 58(1): 5–17. DOI: 10.1093/rheumatology/key006
Zhao Z., Wei Y., Tao C. An enlightening role for cytokine storm in coronavirus infection. Clin Immunol. 2021; 222: DOI: 10.1016/j.clim.2020.108615
Pelaia C., Tinello C., Vatrella A., et al. Lung under attack by COVID-19-induced cytokine storm: pathogenic mechanisms and therapeutic implications. Ther Adv Respir Dis. 2020; 14: 1753466620933508. DOI: 10.1177/1753466620933508
Vaninov N. In the eye of the COVID-19 cytokine storm. Nat Rev Immunol. 2020; 20(5): 277. DOI: 10.1038/s41577-020-0305-6
de la Rica R., Borges M., Gonzalez-Freire M. COVID-19: In the Eye of the Cytokine Storm. Front Immunol. 2020; 11: Published 2020 Sep 24. DOI: 10.3389/fimmu.2020.558898
Song P., Li W., Xie J., Hou Y., You C. Cytokine storm induced by SARS-CoV-2. Clin Chim Acta. 2020; 509: 280–287. DOI: 10.1016/j.cca.2020.06.017
Khosroshahi L.M., Rezaei N. Dysregulation of the Immune Response in COVID-19. Cell Biol Int. 2020: 1002/cbin.11517. DOI: 10.1002/cbin.11517
Mangalmurti N., Hunter C.A. Cytokine Storms: Understanding COVID-19. Immunity. 2020; 53(1): 19–25. DOI: 10.1016/j.immuni.2020.06.017
Potempa L.A., Rajab I.M., Hart P.C., et al. Insights into the Use of C-Reactive Protein as a Diagnostic Index of Disease Severity in COVID-19 Infections. Am J Trop Med Hyg. 2020; 103(2): 561–563. DOI: 10.4269/ajtmh.20-0473
Yonas E., Alwi I., Pranata R., et al. Elevated interleukin levels are associated with higher severity and mortality in COVID 19 — A systematic review, meta-analysis, and meta-regression. Diabetes Metab Syndr. 2020; 14(6): 2219–2230. DOI: 10.1016/j.dsx.2020.11.011
Lavillegrand J.R., Garnier M., Spaeth A., et al. Elevated plasma IL-6 and CRP levels are associated with adverse clinical outcomes and death in critically ill SARS-CoV-2 patients: inflammatory response of SARS-CoV-2 patients. Ann. Intensive Care 11, 9 (2021). DOI: 10.1186/s13613-020-00798-x.
Moore J.B., June C.H. Cytokine release syndrome in severe COVID-19. Science. 2020; 368(6490): 473–474. DOI: 10.1126/science.abb8925
McGonagle D., Sharif K., O’Regan A., Bridgewood C. The Role of Cytokines including Interleukin-6 in COVID-19 induced Pneumonia and Macrophage Activation Syndrome-Like Disease. Autoimmun Rev. 2020;19(6): DOI: 10.1016/j.autrev.2020.102537
Langer-Gould A., Smith J.B., Gonzales E.G., et al. Early identification of COVID-19 cytokine storm and treatment with anakinra or tocilizumab. Int J Infect Dis. 2020; 99: 291–297. DOI: 10.1016/j.ijid.2020.07.081
Bhaskar S., Sinha A., Banach M., et al. Cytokine Storm in COVID-19-Immunopathological Mechanisms, Clinical Considerations, and Therapeutic Approaches: The REPROGRAM Consortium Position Paper. Front Immunol. 2020; 11: 1648. Published 2020 Jul 10. DOI: 10.3389/fimmu.2020.01648
Caricchio R., Gallucci M., Dass C., et al. Preliminary predictive criteria for COVID-19 cytokine storm. Annals of the Rheumatic Diseases. 2021; 80(1): 88–95. DOI: 10.1136/annrheumdis-2020-218323
Retamozo S., Brito-Zerón P., Sisó-Almirall A., et al. Haemophagocytic syndrome and COVID-19. Clin Rheumatol. 2021. DOI: 10.1007/s10067-020-05569-4
Morris S.B., Schwartz N.G., Patel P., et al. Case Series of Multisystem Inflammatory Syndrome in Adults Associated with SARS-CoV-2 Infection — United Kingdom and United States, March-August 2020. MMWR Morb Mortal Wkly Rep. 2020; 69(40): 1450–1456. DOI: 10.15585/mmwr.mm6940e1
Leisman D.E., Ronner L., Pinotti R., et al. Cytokine elevation in severe and critical COVID-19: a rapid systematic review, metaanalysis, and comparison with other inflammatory syndromes. Lancet Respir Med. S2213–2600: 30404–30405. DOI: 10.1016/S2213-2600(20)30404-5
Liu D., Zhang T., Wang Y., Xia L. Tocilizumab: The Key to Stop Coronavirus Disease 2019 (COVID-19)-Induced Cytokine Release Syndrome (CRS)? Front Med (Lausanne). 2020; 7: Published 2020 Oct 26. DOI: 10.3389/fmed.2020.571597
Miao Y., Fan L., Li J.Y. Potential Treatments for COVID-19 Related Cytokine Storm — Beyond Corticosteroids. Front Immunol. 2020 Jun 16;11:1445. DOI: 10.3389/fimmu.2020.01445.
Cavalli G., Farina N., Campochiaro C., et al. Repurposing of Biologic and Targeted Synthetic Anti-Rheumatic Drugs in COVID-19 and Hyper-Inflammation: A Comprehensive Review of Available and Emerging Evidence at the Peak of the Pandemic. Front Pharmacol. 2020; 11: 598308. Published 2020 Dec 18. DOI: 10.3389/fphar.2020.598308
D’Elia R.V., Harrison K., Oyston P.C., et al. Targeting the “Cytokine Storm” for Therapeutic Benefit. Clinical and Vaccine Immunology. 2013; 20(3): 319–327; DOI: 10.1128/CVI.00636-12
Wong J.P., Viswanathan S., Wang M., et al. Current and future developments in the treatment of virus-induced hypercytokinemia. Future Med Chem. 2017; 9(2): 169–178. DOI: 10.4155/fmc-2016-0181
Xu X., Han M., Li T., et al. Effective treatment of severe COVID-19 patients with tocilizumab. Proceedings of the National Academy of Sciences. 2020; 117(20): 10970–10975. DOI: 10.1073/pnas.2005615117
Narazaki M., Kishimoto T. The Two-Faced Cytokine IL-6 in Host Defense and Diseases. Int J Mol Sci. 2018; 19(11): DOI: 10.3390/ijms19113528
Ritchie A.I., Singanayagam A. Immunosuppression for hyperinflammation in COVID-19: a double-edged sword? Lancet. 2020; 395(10230): DOI: 10.1016/S0140-6736(20)30691-7
Lang V.R., Englbrecht M., Rech J., et al. Risk of infections in rheumatoid arthritis patients treated with tocilizumab. Rheumatology (Oxford). 2012;51 (5): 852–857. DOI: 10.1093/rheumatology/ker223
Halyabar O., Chang M.H., Schoettler M.L., et al. Calm in the midst of cytokine storm: a collaborative approach to the diagnosis and treatment of hemophagocytic lymphohistiocytosis and macrophage activation syndrome. Pediatr Rheumatol Online J. 2019; 17(1): 7. DOI: 10.1186/s12969-019-0309-6
Kim J.S., Lee J.Y., Yang J.W., et al. Immunopathogenesis and treatment of cytokine storm in COVID-19. Theranostics. 2021; 11(1): 316–329. DOI: 10.7150/thno.49713
Han Q., Guo M., Zheng Y., et al. Current Evidence of Interleukin-6 Signaling Inhibitors in Patients With COVID-19: A Systematic Review and Meta-Analysis. Front Pharmacol. 2020; 11: 615972. DOI: 10.3389/fphar.2020.615972
Schoot T.S., Kerckhoffs A.P.M., Hilbrands L.B., et al. Immunosuppressive Drugs and COVID-19: A Review. Front Pharmacol. 2020; 11: 1333. DOI: 10.3389/fphar.2020.01333
Tleyjeh I.M., Kashour Z., Damlaj M., et al. Efficacy and safety of tocilizumab in COVID-19 patients: a living systematic review and meta-analysis [published online ahead of print, 2020 Nov 5]. Clin Microbiol Infect. 2020; 27(2): 215–227. DOI: 10.1016/j.cmi.2020.10.036
Richier Q., Plaçais L., Lacombe K., Hermine O. COVID-19: encore une place pour le tocilizumab? Rev Med Interne. 2021; 42(2):73–78. DOI: 10.1016/j.revmed.2020.11.016
Nasonov E., Samsonov M. The role of Interleukin 6 inhibitors in therapy of severe COVID-19. Biomed Pharmacother. 2020; 131: DOI: 10.1016/j.biopha.2020.110698
Rosas I., Bräu N., Waters M., et al. Tocilizumab in Hospitalized Patients With COVID-19 Pneumonia. medRxiv. 2020.08.27.20183442. DOI: 10.1101/2020.08.27.20183442
Hermine O., Mariette X., Tharaux P.L., et al. CORIMUNO-19 Collaborative Group. Effect of Tocilizumab vs Usual Care in Adults Hospitalized With COVID-19 and Moderate or Severe Pneumonia: A Randomized Clinical Trial. JAMA Intern Med. 2021; 181(1): 32–40. DOI: 10.1001/jamainternmed.2020.6820
Stone J.H., Frigault M.J., Serling-Boyd N.J., et al. BACC Bay Tocilizumab Trial Investigators. Efficacy of Tocilizumab in Patients Hospitalized with Covid-19. N Engl J Med. 2020; 383(24): 2333–2344. DOI: 10.1056/NEJMoa2028836
Salvarani C., Dolci G., Massari M., et al. Effect of Tocilizumab vs Standard Care on Clinical Worsening in Patients Hospitalized With COVID-19 Pneumonia: A Randomized Clinical Trial. JAMA Intern Med. 2021; 181(1): 24–31. DOI: 10.1001/jamainternmed.2020.6615
Veiga V.C., Prats J., Farias D., et al. Effect of tocilizumab on clinical outcomes at 15 days in patients with severe or critical coronavirus disease 2019: randomised controlled trial. BMJ. 2021; 372: n84. DOI: 10.1136/bmj.n84
Mogensen T.H., Paludan S.R. Molecular pathways in virus-induced cytokine production. Microbiol Mol Biol Rev. 2001; 65(1): 131–150. DOI:1128/MMBR.65.1.131-150.2001
Kimura H., Yoshizumi M., Ishii H., et al. Cytokine production and signaling pathways in respiratory virus infection. Front Microbiol. 2013; 4: 276. DOI: 10.3389/fmicb.2013.00276
Schwarze J., Mackenzie K.J. Novel insights into immune and inflammatory responses to respiratory viruses. Thorax. 2013; 68(1): 108–110. DOI:1136/thoraxjnl-2012-202291
Bhattacharyya S. Inflammation During Virus Infection: Swings and Roundabouts. Dynamics of Immune Activation in Viral Diseases. 2019; 43–59. DOI:1007/978-981-15-1045-8_3
Sinha P., Matthay M.A., Calfee C.S. Is a “Cytokine Storm” Relevant to COVID-19? JAMA Intern Med. 2020; 180(9): 1152–1154. DOI:1001/jamainternmed.2020.3313.
Mudd P.A., Crawford J.C., Turner J.S., et al. Distinct inflammatory profiles distinguish COVID-19 from influenza with limited contributions from cytokine storm. Sci Adv. 2020; 6(50): eabe3024. DOI: 10.1126/sciadv.abe3024
Nigrovic P.A. COVID-19 cytokine storm: what is in a name? Ann Rheum Dis 2021; 80: 3–5. DOI: 10.1136/annrheumdis-2020-219448
Brikman S., Bieber A., Dori G. The Hyper-Inflammatory Response in Adults with Severe COVID-19 Pneumonia Differs from the Cytokine Storm of Hemophagocytic Syndrome. Isr Med Assoc J. 2020; 22(8): 505–513.
Lorenz G., Moog P., Bachmann Q., et al. Cytokine release syndrome is not usually caused by secondary hemophagocytic lymphohistiocytosis in a cohort of 19 critically ill COVID-19 patients. Sci Rep. 2020; 10(1): 18277. DOI: 10.1038/s41598-020-75260-w
Gao Y., Wang C., Kang K., et al. Cytokine Storm May Not Be the Chief Culprit for the Deterioration of COVID-19. Viral Immunol. 2020, Nov 17. DOI: 10.1089/vim.2020.0243
Blot M., Bourredjem A., Binquet C., Piroth L. LYMPHONIE Study Group. Is IL-6 the Right Target in COVID-19 Severe Pneumonia? Am J Respir Crit Care Med. 2021; 203(1): 139–140. DOI: 10.1164/rccm.202007-2924LE
Kox M., Waalders N.J.B., Kooistra E.J., et al. Cytokine Levels in Critically Ill Patients With COVID-19 and Other Conditions. JAMA. 2020; 324(15): 1565–1567. DOI: 10.1001/jama.2020.17052
Remy K.E., Mazer M., Striker D.A., et al. Severe immunosuppression and not a cytokine storm characterizes COVID-19 infections. JCI Insight. 2020; 5(17): e140329. DOI: 10.1172/jci.insight.140329
Riva G., Nasillo V., Tagliafico E., et al. COVID-19: more than a cytokine storm. Critical Care. 2020; 24: 549. DOI: 10.1186/s13054-020-03267-w
Kiselevskiy M., Shubina I., Chikileva I., et al. Immune Pathogenesis of COVID-19 Intoxication: Storm or Silence? Pharmaceuticals (Basel). 2020; 13(8):166. DOI: 10.3390/ph13080166
Descartes R. Regles pour la direction de l’esprit. Edité par: Vrin, 1988.