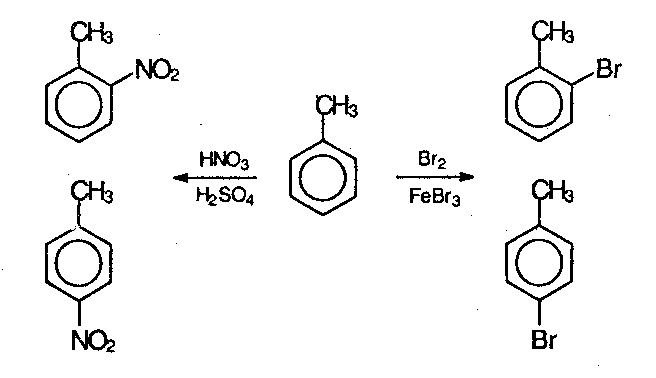
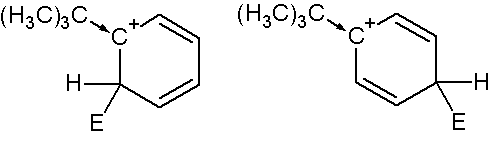
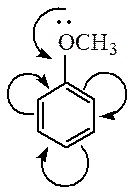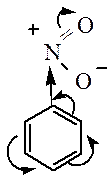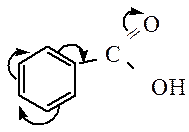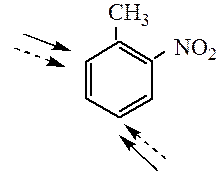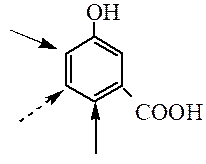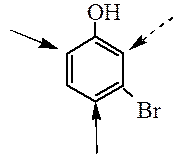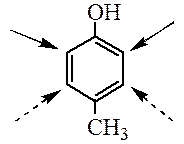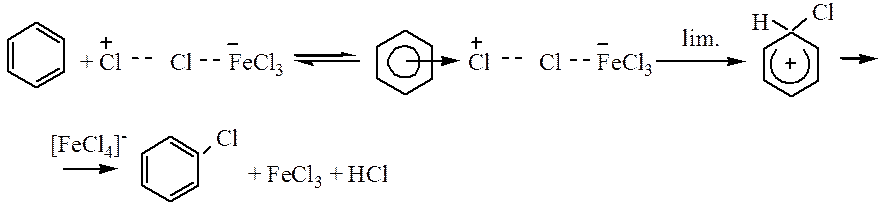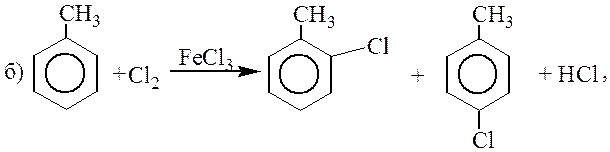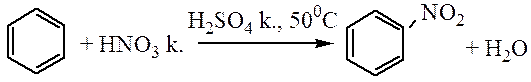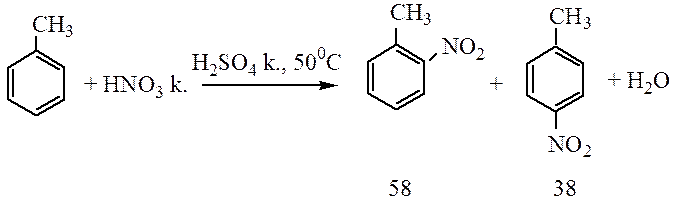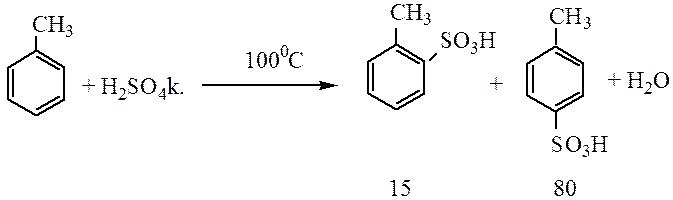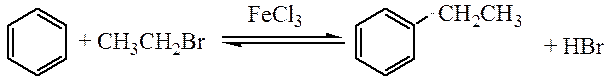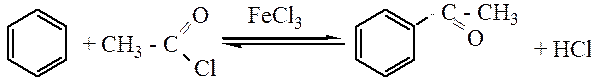нитрогруппа ориентант какого рода
Имеющийся в кольце заместитель не только влияет на реакционную способность, но и проявляет ориентирующее действие по отношению к вводимому в кольцо электрофилу.
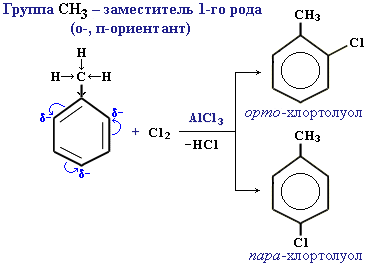
Ориентирующее влияние заместителей обусловлено их электронными эффектами (статический фактор). Статический фактор отражает распределение электронной плотности в молекуле субстрата. Например, в толуоле электрондонорная группа повышает электронную плотность на всех атомах углерода кольца, но особенно в орто- и пара- положениях.
По влиянию статических и динамических факторов на реакционную способность и ориентацию в реакциях электрофильного замещения заместители делятся:
-CH3 +I слабо активируют
Если по силе действия +М эффект от группы превосходит –I эффект, то орто- и параориентант обогащает бензольное ядро электронной плотностью. В деформированной π-системе эта плотность у атомов углерода повышается не равномерно, и в орто- и пара-положениях возникает частичный отрицательный заряд, облегчая атаку электрофила в этих положениях.
Правила ориентации в дизамещенных аренах. В дизамещенных производных бензола ориентирующее влияние заместителей будет согласованным, если заместители направляют электрофильный реагент в одни и те же положения кольца.
При несогласованной ориентации заместители конкурируют между собой, можно предсказать основное направление реакции, руководствуясь следующими обобщениями:
Реакции моноядерных аренов:
Галогенирование. Бензол в обычных условиях не взаимодействует с хлором или бромом. Реакция протекает только в присутствии катализаторов – кислот Льюиса:
Роль катализатора заключается в поляризации нейтральной молекулы галогена, ведущей к образованию электрофильной частицы. Механизм реакции хлорирования может быть представлен следующим образом:
Алкилбензолы, вследствие электронодонорного эффекта алкильных групп более реакционноспособны в реакциях электрофильного замещения, чем бензол:
Фторирование протекает слишком бурно, и уже при комнатной температуре происходит деструкция молекул субстрата. Иодирование протекает очень медленно.
Нитрование. Бензол реагирует с концентрированной азотной кислотой очень медленно даже при нагревании. При действии же смесью концентрированных азотной и серной кислот (нитрующая смесь) легко происходит замещение водорода в кольце на нитрогруппу:
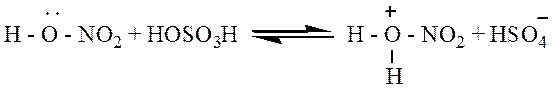 |
Алкилбензолы в реакциях нитрования более реакционноспособны, чем бензол:
Сульфирование. При взаимодействии бензола с серной кислотой или олеумом происходит замещение водорода с образованием бензолсульфоновой кислоты:
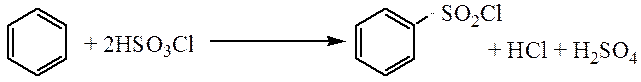
Сульфохлорирование. Взаимодействие с хлорсульфоновой кислотой, с образованием бензолсульфохлорида, который растворим в органических растворителях в отличае от бензолсульфоновой кислоты и его легче выделить из реакционной смеси.
Алкилирование. В результате этой реакции в бензольное ядро вводятся алкильные группы с образованием гомологов бензола. В качестве алкилирующих реагентов можно использовать галогеналканы, алкены или спирты.
Алкилирование по Фриделю-Крафтсу (1877) осуществляется в присутствии кислот Льюиса:
Вводимый алкильный заместитель, являясь электронодонором, активрует бензольное кольцо в реакциях электрофильного замещения, что может привести к полиалкилированию. Во избежание этого используется избыток ароматического углеводорода. Арены, содержащие сильные электронноакцепторные заместители, в реакцию алкилирования не вступают. Ароматиские амины, несмотря на наличие электронодонорной аминогруппы, в реакцию алкилирования тоже не вступают, что объясняется потерей активирующего действия аминогруппы за счет взаимодействия ее с катализатором.
Ацилирование. В качестве ацилирующего реагентов чаще всего используют хлорангидриды или ангидриды кислот. Ацилирование по Фриделю-Крафтсу осуществляется в присутствии кислот Льюиса.
Чтобы распечатать файл, скачайте его (в формате Word).
Правила ориентации в бензольном кольце.
Основным фактором, который определяет химические свойства молекулы, является распределение электронной плотности. Характер распределения зависит от взаимного влияния атомов.
Влияние атомов осуществляется через индуктивный эффект (по σ-связи). В молекулах, предоставляющих собой сопряженный системы, имеет место мезомерный эффект: влияние заместителей, передающееся по сопряженной системе π-связей.
Если в кольцо ввести какой-нибудь заместитель, то равномерное распределение нарушается и происходит перераспределение электронной плотности в кольце. Место вступления второго заместителя в бензольном кольце определяется природой заместителя.
Заместители делят на 2 группы в зависимости от проявляемого эффекта (мезомерного и индуктивного): электронодонорного и электроноакцепторные.
В результате электронная плотность сосредотачивается в орто- и пара- положениях:
Алкильные группы проявляют +I—эффект, под действием которого наблюдается перераспределение π-электронной плотности.
Такие заместители образуют сопряженную систему, но электронная система сдвигается в сторону этих групп. Поэтому электронная плотность уменьшается и в большей степени – в мета-положении:
Галогены проявляют –I-эффект, что также способствуют понижению электронной плотности кольца.
Такие закономерности носят названия правил ориентации в бензольном кольце.
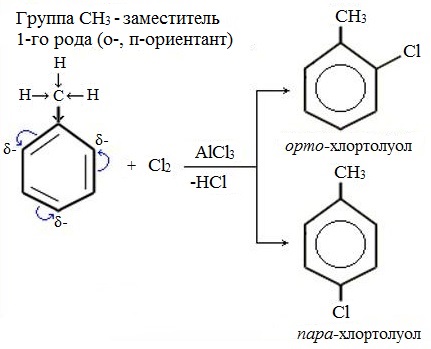
Заместители, которые проявляют +I— эффект или +М – эффект, направляют замещение в орто- и пара-положения бензольного кольца, и называются такие заместители – ориентантами (заместителями) первого рода:
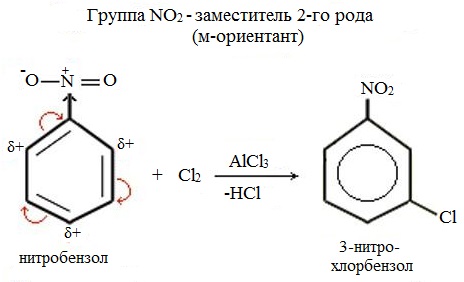
Заместители, обладающие –I и –М –эффектами, направляют замещение в мета-положение бензольного кольца, и называются заместителями второго рода:
Ориентанты 1го рода облегчают вступление второго заместителя, ориентанты 2го – затрудняют его.
Нитрогруппа ориентант какого рода
В молекуле бензола π-электронное облако распределено равномерно между всеми атомами углерода. Но если в бензольное кольцо ввести какой-нибудь заместитель, то равномерность распределения π-электронной плотности нарушается. В результате этого бензольное кольцо становится частично поляризованным, и место вступления нового заместителя определяется природой уже имеющегося заместителя.
По своему направляющему действию все заместители делятся на две группы: ориентанты I рода и ориентанты II рода.
Ориентанты I рода (орто-пара-ориентанты) – это группировка атомов, способных отдавать электроны (электродоноры):
– R, – ОН, – OR, – OCOR, –SH, – SR, – NH2, – NHR, – NHCOR, –N=N–, – CH3, – CH2R, – CR3, – Hal (F, Cl, Br, I)
Электродонорные заместители проявляют +М и/или +I-эффект и повышают электронную плотность в сопряженной системе, например:
Эти заместители смещают электронную плотность в сторону бензольного кольца. Облегчая вхождение электрофильных реагентов в бензольное кольцо, они ориентируют новый заместитель в орто- и пара-положения.
Ориентанты I рода, повышая электронную плотность в бензольном кольце, увеличивают его активность в реакциях электрофильного замещения по сравнению с незамещенным бензолом.
Электроноакцепторные заместители проявляют –М-эффект и/или –I-эффект и снижают электронную плотность в сопряженной системе, например:
Эти заместители смещают электронную плотность от бензольного кольца, особенно в орто- и пара-положениях на себя, создавая частичный отрицательный заряд в мета-положении.
Поэтому электрофил атакует атомы углерода не в этих положениях, а в мета-положении, где электронная плотность несколько выше.
Все ориентанты II рода, уменьшая в целом электронную плотность в бензольном кольце, снижают его активность в реакциях электрофильного замещения.
Таким образом, легкость электрофильного замещения для соединений ниже, уменьшается в ряду:
Помимо ориентирующего действия заместители оказывают влияние и на реакционную способность бензольного кольца: ориентанты I-го рода (кроме галогенов) облегчают вступление второго заместителя; ориентанты II-го рода (и галогены) затрудняют его.
Нитрогруппа ориентант какого рода
При реакции бензола (типичной ароматической системы) все шесть положений для вхождения замещающей водород группы равнозначны и затруднений здесь не возникает. Однако, вхождение каждого следующего заместителя подчиняется определенным закономерностям, а именно, зависит от типа атакующей частицы и уже имеющегося в кольце заместителя.
Наиболее распространенными типами реакций в ароматике являются электрофильное и нуклеофильное замещения. В первом случае атакующей ароматическую систему является электронодефицитная частица ( электрофил ), имеющая полный положительный заряд или недостаток электронной плотности на одном из атомов. При атаке такая частица “отыскивает” область в кольце, обогащенную электронной плотностью.
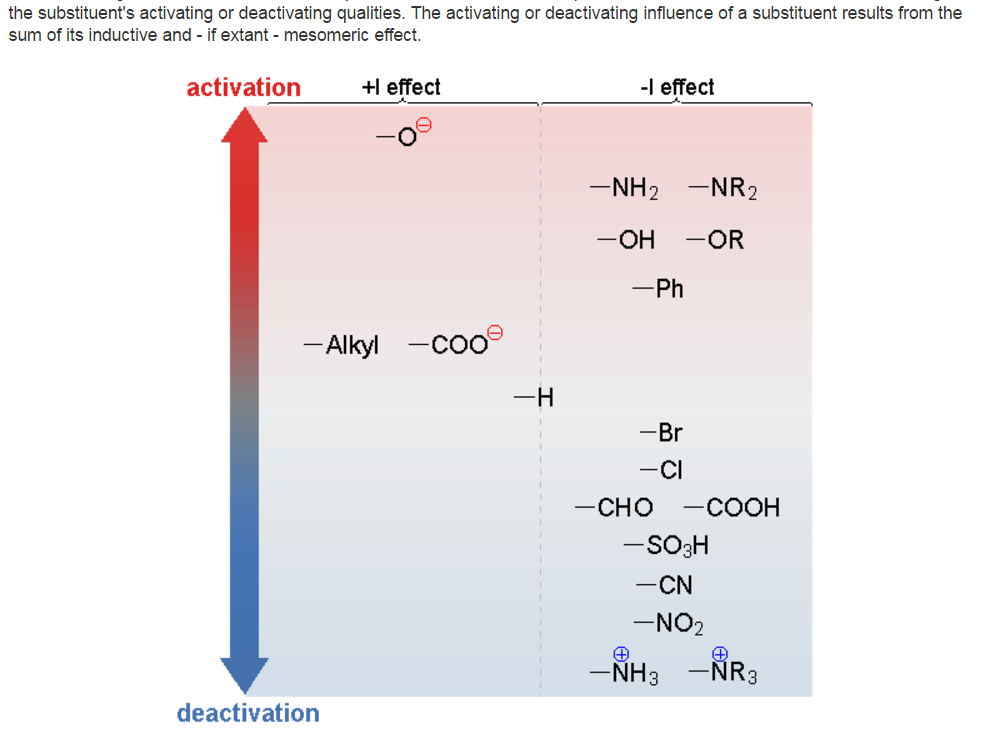
Сводная таблица заместителей и их электронных эффектов
Заместитель или группа атомов
Ориентация при S E Ar
(галогены- дезактивирующие)
м- ориентация, с дезактивированием
Атом, не имеющий р-орбиталей, но с полным положительным зарядом
м- ориентация, с дезактивированием
Они являются АКТИВИРУЮЩИМИ реакцию электрофильного замещения о- и п- ориентантами (заместители I рода). Галогены, благодаря наличию у них +М- эффекта также являются ориентантами I рода (о-, п-), но вследствие сильного – I эффекта они понижают реакционную способность бензольного кольца в реакциях электрофильного замещения. Замещение в активированных системах протекает намного легче замещения в бензоле и в о- и п- положения относительно замсетителя первого рода:
Поэтому они являются дезактивирующими реакцию электрофильного замещения м- ориентантами. Это означает что электрофильное замещение в системе с такими заместителями затруднено и протекает только в сравнительно незатронутые м- положения кольца. Такие заместители относят к заместителям II рода:
На рисунке ниже показаны некоторые из заместителей (группировок атомов), вид и относительная величина их индуктивных эффектов, а также влияние на протекание реакций электрофильного замещения в ароматических системах (ускорение или замедление):
Заместители II рода реакции нуклеофильного замещения облегчают, снижая электронную плотность в кольце и на замещаемом атоме:
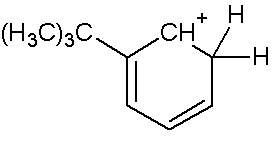
Так, несмотря на отсутствие +М эффекта у трет-бутильной группировки, она является выраженным о-, п- ориентантом, что легко доказать написанием резонансных структур сигма-комплексов, из которых очевидно следует, что вхождение заместителя в орто- и пара- положения приводит к образованию более стабильных сигма- комплексов (стабилизация +I эффектом трет-бутильной группы),
чем при образовании комплекса в мета-положении, где нет прямого влияния заместителя:
Аналогичные структуры можно написать для сигма комплексов с четвертичным атомом азота.
Органическая химия
для студентов, обучающихся по направлению «Техносферная безопасность»
Ароматические соединения
Ароматические соединения (арены) – циклические соединения содержащие, как правило 5- и 6-членные циклы, имеющие замкнутую систему сопряженных связей. Боковые цепи не обязаны содержать сопряженные связи.
Номенклатура и классификации
Термин «ароматические соединения» обязан наличию запаха у многих представителей этого класса соединений. В дальнейшем понятие «ароматичность» приобрело другой смысл.
Ароматичность молекулы характеризует ее повышенную устойчивость, которая обусловлена делокализацией π-электронов в циклической системе.
2. Атомы углерода образуют единую плоскость.
3. Цикл из сопряженных связей включает в себя 4n + 2 π-электронов (где n – целое число). Этот принцип называется правилом Хюккеля.
В зависимости от n можно выделить следующие простейшие ароматические системы:
• Системами с 2 π-электронам являются производные катиона циклопропенилия и дикатионциклобутадиена.
• Системы с 6 π-электронами – это бензол и его гомологи – очень распространены в природе, входят в состав всех живых белковых организмов; пяти- и шестичленные циклы, могут содержать один или несколько гетероатомов, обычно азота, кислорода или серы. Распространены в природе и химическом «быту» из них – пиррол, фуран, тиофен, пиридин) [7].
• Системы с 10 π-электронами – это в первую очередь нафталин. Кроме того, широко встречается в природе конденсированные бензольные кольца. Другой представитель – азулен. Это изомер нафталина, содержащий в себе 5- и 7-членные кольца. Азулен часто встречается в эфирных маслах, но распространенность гораздо меньше, чем у бензола и нафталина.
Сюда же относятся индол, хинолин, изохинолин, хиназолин, хиноксалин, другие системы, основанные на бензольном кольце, конденсированном с другим кольцом, в котором находится гетероатом. Широко распространены в природе.
• Системы с 14 π-электронами: антрацен, фенантрен – конденсированные бензольные кольца обоих кольцах. Широко распространены в природе.
Для ароматических соединений часто используют тривиальные названия (толуол, ксилол, кумол и т. п.). Систематические названия строят из названия углеводородного радикала (приставка) и слова бензол (корень):
| С6H5–CH3 | С6H5–C2H5 | С6H5–C3H7 |
| Метилбензол (толуол) | Этилбензол | Пропиленбензол |
Если радикалов более одного, их положение указывается номерами атомов углерода в кольце, с которыми они связаны. Нумерация организовывается таким образом, чтобы заместители имели наименьшую сумму номеров положений. Например:
 |
| 1,2-Диметилбензол 1,3-Диметилбензол 1,4-Диметилбензол |
Для дизамещенных бензолов R–C6H4–R распространен способ построения названий, при котором положение заместителей указывают перед тривиальным названием соединения приставками:
Ароматические одновалентные радикалы имеют общее название «арил». Из них наиболее распространены в номенклатуре органических соединений два: C6H5– (фенил) и C6H5CH2– (бензил).
Изомерия (структурная)
Строение и физические свойства
Бензол и другие «легкие» гомологи – бесцветные жидкие вещества (см. табл.), нерастворимы в воде, но хорошо растворяющиеся во многих органических жидкостях. Легче воды. Легко воспламеняются. Бензол является очень токсичным веществом [8].
| Название | Формула | Т. пл., °С | Т. кип., °С |
|---|---|---|---|
| Бензол | C6H6 | 5,5 | 80 |
| Толуол | C6H5CH3 | –95 | 111 |
| Этилбензол | C6H5C2H5 | –95 | 136 |
| Изопропилбензол (кумол) | C6H5CH(CH3)2 | –96 | 152 |
| Стирол | C6H5CH=CH2 | –31 | 145 |
Химические свойства
Химические свойства ароматических соединений сильно отличаются от свойств других классов соединений из-за делокализации шести π-электронов в циклической системе, которые понижают энергию молекулы. В результате в молекуле повышается устойчивость. Арены практически не вступают в реакции присоединения или окисления, приводящие к нарушению ароматичности. Для них наиболее распространены реакции с сохранением ароматической системы, т. е. замещения атомов водорода в составе цикла.
Так как в бензольном кольце за счет системы сопряженных связей с обеих сторон от плоскости кольца наблюдается повышенная электронная плотность, то бензольное кольцо является нуклеофилом и склонно взаимодействовать с электрофильным реагентом. Поэтому для ароматических соединений наиболее типичны реакции электрофильного замещения.
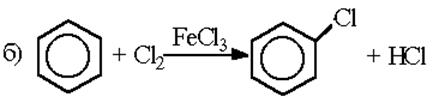
Галогенирование
Замена атома водорода в бензольном кольце на какой-либо из галогенов наблюдается, как правило, в присутствии катализаторов AlCl3, AlBr3, FeCl3 (кислот Льюиса):
| C6H6 + Cl2 |  | C6H5Cl | + HCl. |
| Хлорбензол |
Нитрование
Бензол хорошо взаимодействует с нитрующей смесью (смесью концентрированных азотной и серной кислот):
| C6H6 + HNO3 |  | C6H5NO2 | + H2O. |
| Нитробензол |
Алкилирование
Алкильная группа замещает атом водорода в бензольном кольце при взаимодействии с алкилгалогенидами (реакция Фриделя–Крафтса) или алкенов с катализатором, например AlCl3 (кислота Льюиса):
| C6H6 + CH3Cl |  | C6H5CH3 | + HCl. |
| Толуол (метилбензол) |
Гомологи бензола, содержащие боковые цепи, активнее вступают в реакции замещения.
Например, при нитровании толуола С6Н5CH3 может происходить замещение не одного, а одновременно трех атомов водорода с образованием 2,4,6-тринитротолуола:
 | ||
| Толуол | 2,4,6-Тринитротолуол (тротил, тол) | |
В этом случае хорошо иллюстрируется взаимное влияние атомов в молекуле на реакционную способность вещества. С одной стороны, метильная группа СH3 (за счет +I-эффекта) повышает электронную плотность в бензольном кольце в положениях 2, 4 и 6 и облегчает замещение именно в этих положениях.
Причиной именно такой ориентации при электрофильном замещении является взаимное влияние атомов в молекуле. В незамещенном бензоле С6Н6 электроны в кольце распределены равномерно, а в замещенных ароматических соединениях под влиянием заместителя происходит перераспределение электронов и образуются области повышенной и пониженной электронной плотности, что оказывает влияние направления реакций электрофильного замещения. Таким образом, атака нового заместителя определяется природой уже имеющегося заместителя.
Правила ориентации
Заместители, имеющиеся в бензольном ядре, направляют вновь вступающую группу в определенные положения, т. е. оказывают ориентирующее действие.
По своему направляющему действию все заместители делятся на две группы: ориентанты первого рода и ориентанты второго рода.
Орто-пара-ориентанты направляют замещение преимущественно в орто- и пара-положения.
К ним относятся электроннодонорные группы (электронные эффекты групп указаны в скобках):
+M-эффект в этих группах сильнее, чем –I-эффект.
Ориентанты 1-го рода повышают электронную плотность в бензольном кольце, особенно на углеродных атомах в орто- и пара-положениях, что благоприятствует взаимодействию с электрофильными реагентами именно этих атомов.
Ориентанты 1-го рода повышают в бензольном кольце электронную плотность, это приводит к повышению его активности в реакциях электрофильного замещения (по сравнению с бензолом).
Галогены занимают особое место среди ориентантов 1-го рода, проявляющие электронно-акцепторные свойства: –F (+M бензол > нитробензол.
Но нужно учитывать, что под влиянием бензольного кольца группа СH3 в толуоле становится активнее в реакциях окисления и радикального замещения по сравнению, например, с метаном СH4.
Поэтому толуол (в отличие от метана) окисляется в мягких условиях (обесцвечивает подкисленный раствор KMnO4 при нагревании):
Реакции присоединения к аренам
В реакции присоединения, приводящие к разрушению ароматической структуры бензольного кольца, арены могут вступать с большим трудом.
Гидрирование
Присоединение водорода к бензолу и его гомологам происходит при повышенной температуре и давлении в присутствии металлических катализаторов.
Радикальное хлорирование аренов
В условиях радикальных реакций (ультрафиолетовое облучение, повышенная температура) возможно присоединение галогенов к ароматическим соединениям. При радикальном хлорировании бензола получен «гексахлоран» (средство борьбы с вредными насекомыми).
Реакции окисления аренов
Бензол не окисляется даже под действием сильных окислителей (KMnO4, K2Cr2O7 и т. п.). Поэтому он часто используется как инертный растворитель при проведении реакций окисления других органических соединений [5, 6].
Гомологи бензола, в отличие от самого бензола, окисляются легко. При обработке перманганатом калия будут окисляться только боковые цепи:
| C6H5–CH3 + 3[O] | → | C6H5–COOH | + H2O. |
| Толуол | Бензойная кислота |
Наращивание боковой насыщенной цепи (этилбензол, пропилбензол и т. д.) также дает на выходе бензойную кислоту, так как разрыв связи происходит между двумя ближайшими к кольцу атомами углерода в боковой цепи.
Алкильные группы в алкилбензолах окисляются легче, чем алканы. Это объясняется влиянием бензольного кольца на атомы в боковой цепи.
Бензол и его гомологи на воздухе горят коптящим пламенем, что обусловлено высоким содержанием углерода в их молекулах:
Бензол и его летучие гомологи образуют с воздухом и кислородом взрывоопасные смеси.
Методы получения
Уголь и нефть – основной источник ароматических углеводородов.
При коксовании каменного угля образуется каменноугольная смола, из которой выделяют бензол, толуол, ксилолы, нафталин и многие другие органические соединения.
а) дегидроциклизация (дегидрирование и циклизация) насыщенных УВ, состоящих, как минимум из 6 атомов углерода в основной цепи. Реакция проходит при нагревании в присутствии катализатора:
б) дегидрирование циклоалканов, состоящих из шести атомов:
Алкилирование бензола галогеналканами или алкенами в присутствии безводного хлорида алюминия:
Тримеризация алкинов над активированным углем (реакция Зелинского):
Применение
Бензол С6Н6 – основа для получения различных ароматических соединений – нитробензола, хлорбензола, анилина, фенола, стирола и т. д., применяемых в производстве лекарств, пластмасс, красителей, ядохимикатов и многих других органических веществ.
Толуол С6Н5–СН3 используется для производства лекарственных и взрывчатых веществ (тротил, тол), а также красителей.
Ксилолы С6Н4(СН3)2 в виде смеси изомеров (орто-, мета- и пара-) применяется как растворитель.
Изопропилбензол (кумол) С6Н4–СН(СН3)2 – основа для получения фенола и ацетона.
Винилбензол (стирол) C6H5–CН=СН2 используется для получения полистирола – важного для промышленности полимера.
Бензпире́н или бензапире́н – химическое соединение, относящееся к первому классу опасности. Источником его образования является сгорание углеводородного жидкого, твёрдого и (реже) газообразного топлива. Концентрируется преимущественно в почве, меньше – в воде. Из почвы мигрирует в ткани растений и продолжает своё движение дальше в пищевой цепочке.